今回の疑問
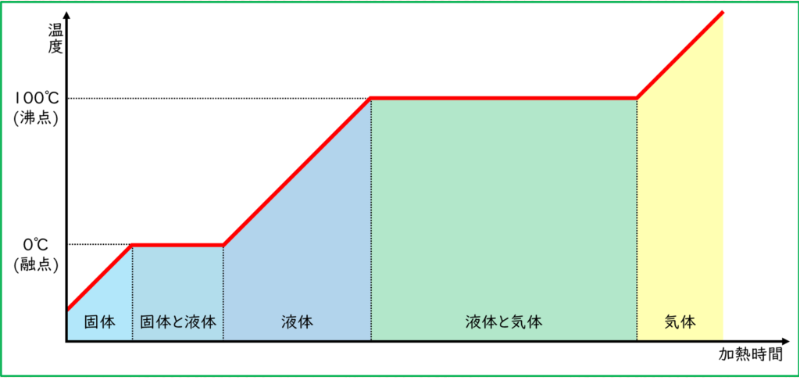
なぜ水を温めると、温度が変化しないエリアができるのか?
引用元 水をあたためたときの状態変化 ~状態変化が起こる温度・状態が変化しているときの熱の出入り~
このグラフ、面白いですよね!よく見ると、「あれ?温度が変わらない部分がある!」って気づきませんか?実は、これにはちゃんと理由があります。氷と水が一緒にいるときや、水と水蒸気が一緒にいるときには、温度が一定になるんです。
それはどうしてでしょうか?
これには「相律」っていうちょっとカッコイイ名前の法則が関係してるんです。
今回は「相律」から、このグラフの説明ができるように勉強しましょう!
理系大学生や、文学を読むのが好きな方のために、こちらのページで無料で多数の本が読めるリンクをまとめています。非常に有益ですので是非お読みください。
物質の状態は何で決まる?
物質の状態を決めるのは、分子の集合度!
物質の状態は、固体・液体・気体の3種類に分かれます。
物質は原子または分子から構成されており、分子の集まりの違いによって、3つの種類に分かれます。
引用元 F012
物質の状態って、分子たちの「仲の良さ」で決まるんです。ちょっとイメージしてみてください。
- 固体は、分子同士がとっても仲良し!お互いにくっついてギュッと集まっています。
- 液体は、まぁまぁ仲が良いけど、固体ほど密じゃない感じ。少し自由に動けるくらいの距離感で集まっています。
- 気体は、分子同士がまるでケンカしたかのように仲が悪い!好き勝手にバラバラに動き回っています。
そして、温度を上げていくとどうなるか?温度が高くなると、分子同士の仲がどんどん悪くなっていきます。
固体→液体→気体の順番に変わっていくのは、この「仲の良さ」が崩れていくからなんです。分子同士がくっついていた結合がゆるんで、最後にはバラバラになっちゃうんですね。
これ、人間にも例えられますよ!寒い時って、みんなで集まって「寒いね〜」って温め合いたくなりますよね。でも、暑くなると「暑いから離れて!」って感じで距離を取りたくなる。そんなイメージを持つと、物質の状態変化がちょっと身近に感じられるんじゃないでしょうか?
物質の状態に影響を与えるのは?
状態に影響を与えるのは、温度と圧力!
水を沸騰させたことがある人なら、「温度が状態に影響を与える」というのは実感できると思います。でも、実は「圧力」も大きな影響を与えるんです!
例えば、水は平地では100℃で沸騰しますが、山の頂上ではもっと低い温度で沸騰します。どうしてかというと、山頂は平地よりも気圧(圧力)が低いからなんです。圧力が低いと、液体が気体になる「沸点」が下がる、つまり低い温度で沸騰するんですね。
逆に、圧力が高くなると、沸点は上がります。これはどういう仕組みなのでしょうか?
沸点と圧力の関係
沸点とは、液体の中の分子が「外に飛び出す力(蒸気圧)」と、周りの空気がそれを抑え込む力(大気圧)が釣り合う温度のことです。圧力が高いというのは、周りから抑え込む力が強いということ。この場合、分子が外に飛び出すにはもっと強い力(高い温度)が必要になります。だから、圧力が高いと沸点も上がるんです。
ちなみに、圧力が高くなると融点も上昇します。しかし、圧力の変化は沸点には大きく影響しますが、融点(固体が液体になる温度)はあまり変わりません。この違いも面白いですよね!
物質の自由度とは?
自由度とは、ある条件のもとで自由に変えられる変数の数!
水(液体)の自由度
引用元 『図解 合金状態図読本』 (横山 享)
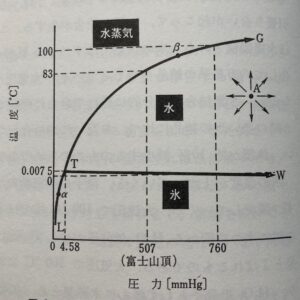
液体の水を例に、水の状態図をもとにして自由度について考えてみましょう。
物質の状態に影響を与えるのは温度と圧力だという話をしましたね。この2つの変数を使って、実際に水がどうなるか見てみましょう。
- まず、水に圧力を加えても、ある範囲内では水の状態は液体のままです。
- また、水の温度を40℃にしても80℃にしても、液体のままです。
- さらに、圧力と温度を同時に変えても、しばらくの間は水は液体のままで変わりません。
このように、温度と圧力を操作しても水が液体でいられる範囲はあるので、「水が液体のままでいられる条件のもとでは、温度と圧力を独立に自由に変えられる」ということになります。つまり、この場合の水の自由度は「2」となります。
水と氷が共存しているときの自由度
引用元 『図解 合金状態図読本』 (横山 享)
皆さん夏には氷を入れた飲み物を飲みますよね。次は、この氷水の自由度を考えてみます。
状態図を見てみると、TWの直線があります。この直線は、水のエリアと氷のエリアを分ける境界線になっています。
水と氷が共存するのは、この直線上の点にあたります。直線上だと、圧力を変えると温度も自動的に変化してしまいますし、逆に温度を変えても圧力が自動的に変わってしまいます。
つまり、氷水の状態では、温度と圧力を”独立して”自由に変えることができません。どちらか一方だけを変えることができるので、氷水の自由度は「1」になります。
相律とは?
相律とは、自由度を導く式!
これまで、水と水+氷の共存している状態での自由度を見てみました。
その際に、水の状態図(1成分系状態図)を用いて自由度を導きました。
でも、実は状態図を見なくても、自由度を導くことができる式が存在するのです!
ギブスの相律
$$F=C+2-P$$
F=自由度、C=系を構成する物質の成分の数、2=圧力と温度、P=物質の相の数
ここで用語の意味を確認します。
系:系とは、「注目する物質」のことです。つまり、注目したい物質だけを考え、それ以外の物質は無視します。
成分:成分は、「系を構成する物質の種類とその数」のことを指します。たとえば、水は1つの物質(成分)なので、1成分です。氷水も水が氷の状態と液体の状態に分かれているだけなので、やはり1成分です。一方、塩水は水と塩が別々に存在するので、2成分となります。
相:相は、「同じ性質を持つ部分」のことです。たとえば、水はどの部分も同じ性質を持つので1相です。氷水では、水と氷は性質が異なるので、2つの異なる相(水の相と氷の相)が共存しています。塩水では、水と塩が異なる性質を持っているため、これも2相となります。
この知識を使って、先ほどの水と氷水の自由度をそれぞれ求めてみましょう。
相律を使った水の自由度
水は1成分であり、均一な性質を持っているので1相です。
したがって、$$C=1 , P=1$$となるので
$$F=1+2-1=2$$
したがって、相律から水の自由度が2と求めることが出来ました。
状態図から求めた水の自由度も2でしたね。
相律を使った氷水の自由度
氷と水(液体)は、水(H2O)の状態の一部なので、氷水は1成分です。
しかし、氷と水は性質がことなるので、2つが共存する氷水は2相です。
よって、$$C=1 , P=2$$となりますから、相律より
$$F=1+2-2=1$$
したがって、相律からも氷水の自由度が1というのを求めることができました。
今日の疑問への解答
引用元 水をあたためたときの状態変化 ~状態変化が起こる温度・状態が変化しているときの熱の出入り~
圧力を固定したときの相律
先ほど相律が$$F=C+2-P$$という式で表されることを見ました。これは圧力も温度も自由に制御できるときの式です。でも、普段の生活では圧力なんてあんまり意識しませんよね?私たちが住んでいる地球の表面では、大気圧がほぼ一定だからです。だから、私たちが火を使ってやかんの中の水を温めるとき、いじれるのは温度だけ!このグラフも、圧力が大気圧で固定されています。
相律の式の「2」という数字は、圧力と温度の自由度を表しているので、このグラフで使う相律は
$$F=C+1-P$$
ということになります。圧力を固定して、温度だけ動かせるから「2」を「1」にしました。この相律を使って、このグラフの説明をしていきます!
共存するエリアの自由度とその意味
氷と水、水と水蒸気が共存している時に温度が一定になるのは何故か?というのが疑問でしたよね?氷水の例から、成分の数は1、相の数は2なので、共存しているときの自由度は相律から
$$F=1+1-2=0$$
よって「0」ってことになります。自由に変えられる変数がないということ。言い換えると、温度が一定になるということを意味します!
その他のエリアの自由度とその意味
では、氷だけ、水だけ、水蒸気だけの状態になるとどうなるか?このときは成分も相の数も1なので相律より
$$F=1+1-1=0$$
よって自由度が「1」になります。つまり、一つの変数を自由に変えられるという意味です。だから温度を変化させることができます。
これで今回の疑問を相律で説明することができました!
まとめ
相律を使って、なぜ温度が変化しないのかという問題を解決できました!
まとめると
・氷と水、水と水蒸気が共存する状態では、相律より自由度が0なので温度が変化しない
・氷だけ、水だけ、水蒸気だけの状態では、相律より自由度が1なので温度が変化する
ということになります。
疑問となったグラフは、ただの線じゃなくて、物質の変化や自然のルールがぎゅっと詰まってるんですね!こういう視点で見ると、科学って少しワクワクしてきませんか?
理系大学生や、文学を読むのが好きな方のために、こちらのページで無料で多数の本が読めるリンクをまとめています。非常に有益ですので是非お読みください。
参考文献
『図解 合金状態図読本』第1版 (横山 享)