はじめに:電気ってどうやって「ためる」の?
普段、電化製品はプラグを抜き差しして「電気を流して使う」のは当たり前ですよね?
そう考えると…
電化製品は電流を流さなきゃ動かないのに、モバイルバッテリーはどうして“ためて”おけるの?
と思いませんか?
実はそのカギは“見えない化学反応”にあるんです。
今回はそんな不思議を、高校生でもわかるように、やさしく解説していきます!
1. そもそも電気ってなに?
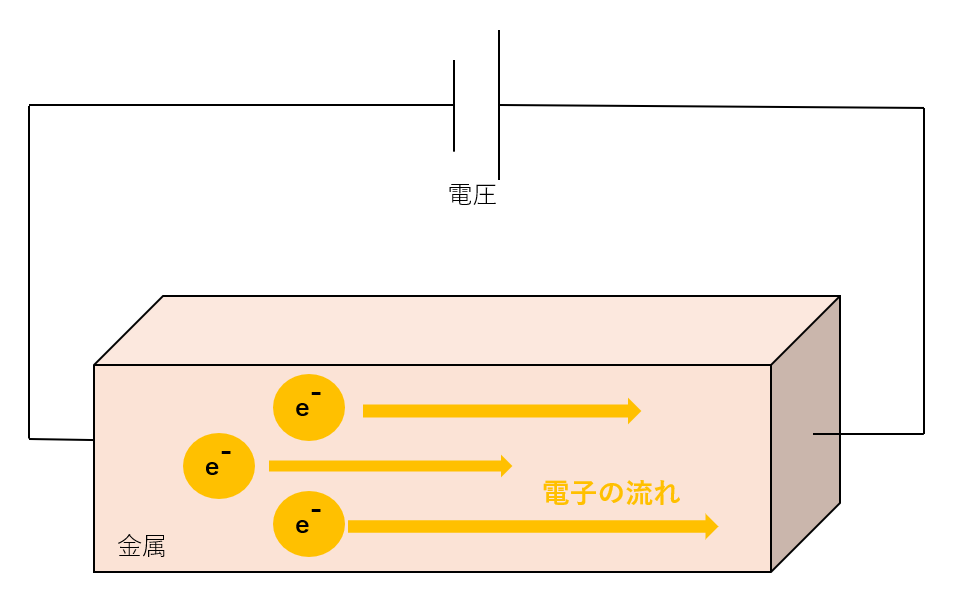
電気・電流って、実は「電子(e⁻)」というマイナスの電荷を持つすごく小さな粒が流れることなんです。
電子は、金属の中で自由に動けます。そこに電池やコンセントから「電圧」をかけると、電子が一定の方向に流れ出します。これが「電流」を生み出します!
2. モバイルバッテリーの中身「リチウムイオン電池」
モバイルバッテリーの正体は、「リチウムイオン電池」という電池です。
この電池は1991年にソニーが開発し、今ではスマホ、ノートPC、電気自動車など、ありとあらゆるものに使われています。
中身はこんな構造:
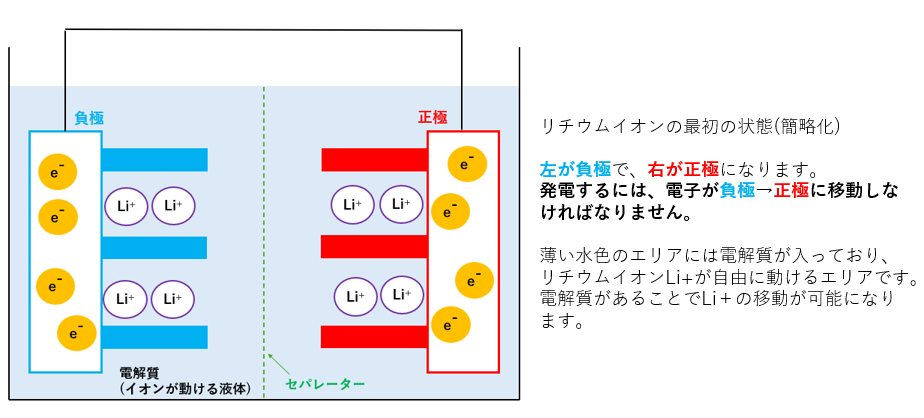
- 正極(プラス):リチウムの化合物
- 負極(マイナス):グラファイト(鉛筆の芯と同じやつ。リチウムイオンを吸収できる。)
- 電解質:リチウムイオンLi+が移動する液体
- セパレーター:プラスとマイナスがぶつからないようにする膜
これらを用いて作られたリチウムイオン電池では、リチウムイオン(Li⁺)が行ったり来たりすることで電気をためたり使ったりできるんです。
3. 電気を“ためる”=化学反応を使ってる!
さて、ここが一番大事なところ。
リチウムイオン電池内では、リチウムイオンが引っ越しすることで、電気をためる・出すことができる!
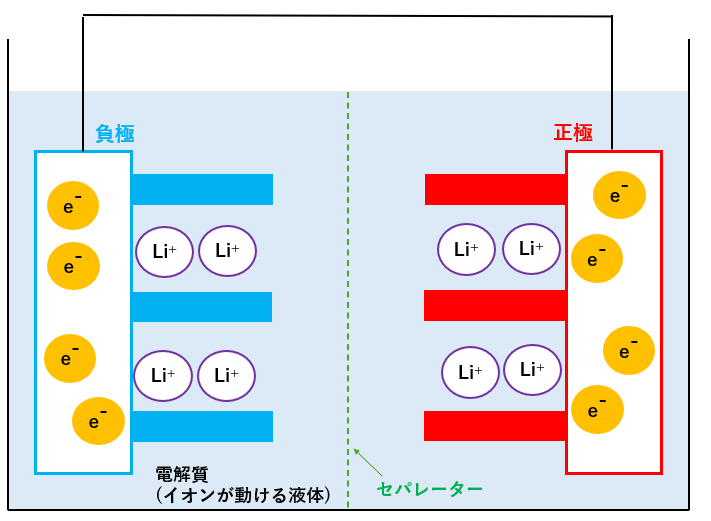
リチウムイオンの最初の状態(簡略化)
左側が負極で、右側が正極になります。
この電池の場合、電子は導線を通って正極にも負極にも移動できますが、電子が負極→正極に移動する際に発電=放電できます。
また、薄い水色のエリアには電解質が入っており、リチウムイオンLi+が自由に動けるエリアです。電解質があることでLi+の移動が可能になります。
充電のとき
初期状態
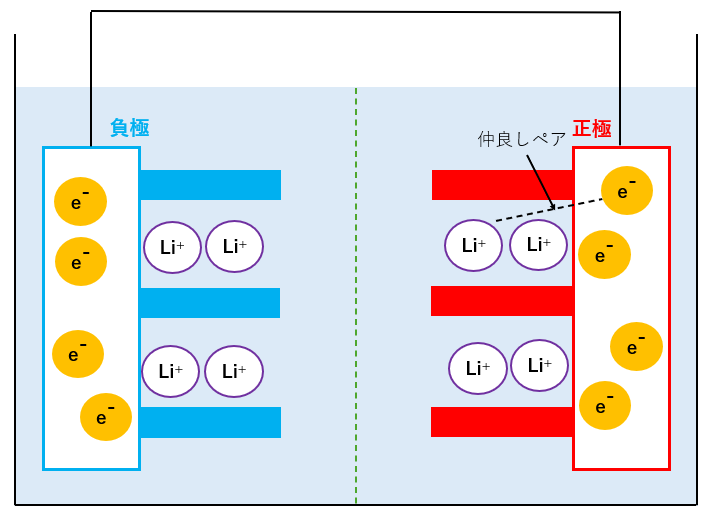
本来Liとして存在しているリチウムですが、電解質によって電離して、リチウムイオンLi+と電子e-のペアのような状態になっています。
Li+は電解質中にいますが、電子は正極や負極といった金属中にいます。
ここでは簡単に、正極側のLi+とe-の一組の”仲良しペア”の動きを見ていきます。
リチウムイオンと電子が負極側に動いて充電
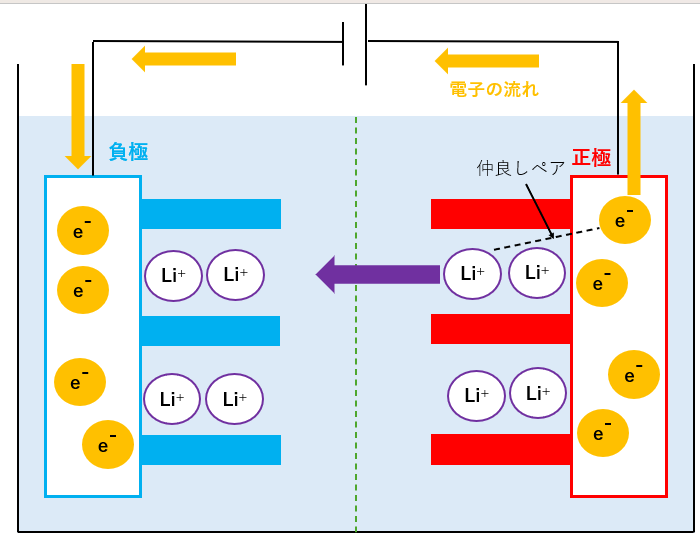
電圧を加えると、正極側のLi+が負極側に力を受けて左側に移動します。
この時、仲良しペアの電子は、Li+と一緒にいたいので、導線を通って左側に移動します。
この際の電子は、正極→負極に移動しているので、発電には使えません。
充電完了
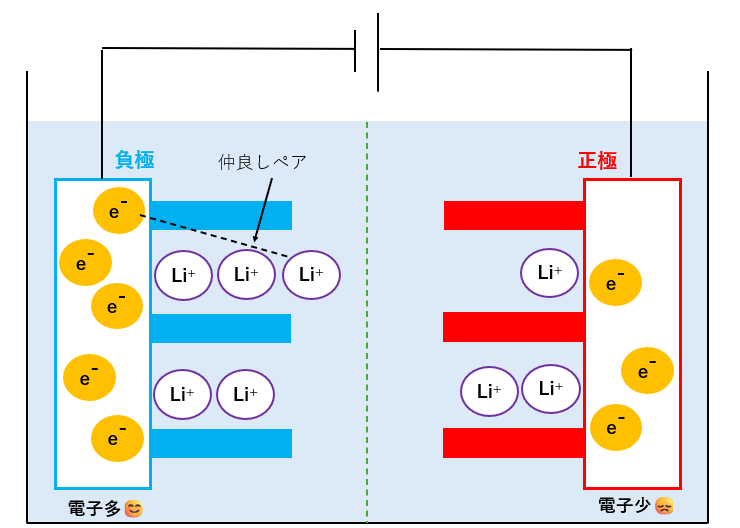
Li+と電子(1組の仲良しペア)の移動が終わった様子です。
負極側の電子が多くて、正極側の電子が少なくなっていることが分かります。
発電には、電子が負極→正極に流れることが必要なので、負極の電子が増えたということは、たくさん発電できる状態になった=充電されたということを表しています。
放電のとき(スマホにつないだとき):
充電状態
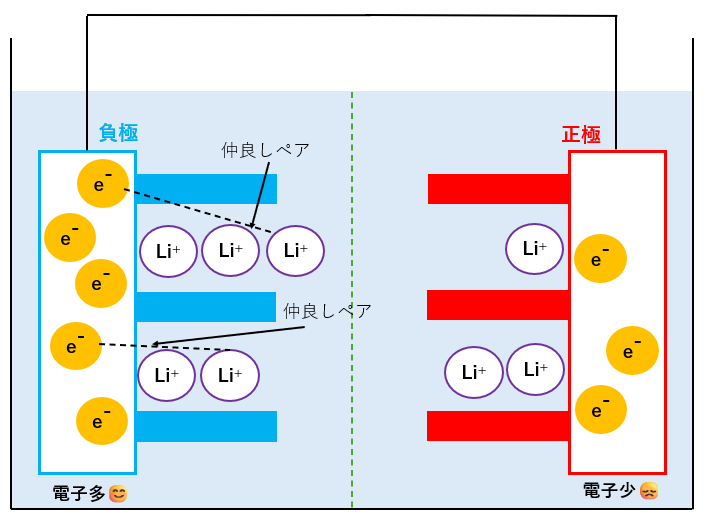
先ほどと同様、充電が終わった後の様子です。
今度は左側のLi+イオンと電子の2組の仲良しペアの移動を考えます。
この図から発電=放電の様子を説明します。
リチウムイオンと電子が正極側に動いて発電
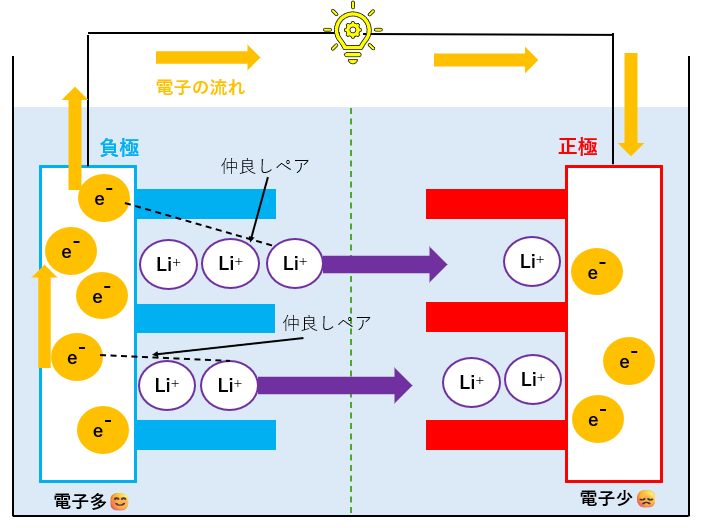
充電時と逆の電圧をかけると、左側にあったLi+は正極側に力を受け、右側に移動します。
仲良しペアの電子は、Li+と一緒にいたいので、導線を通って右側に移動します。
この際、電子は負極→正極に移動するので、発電が可能になります!!
放電(発電)完了
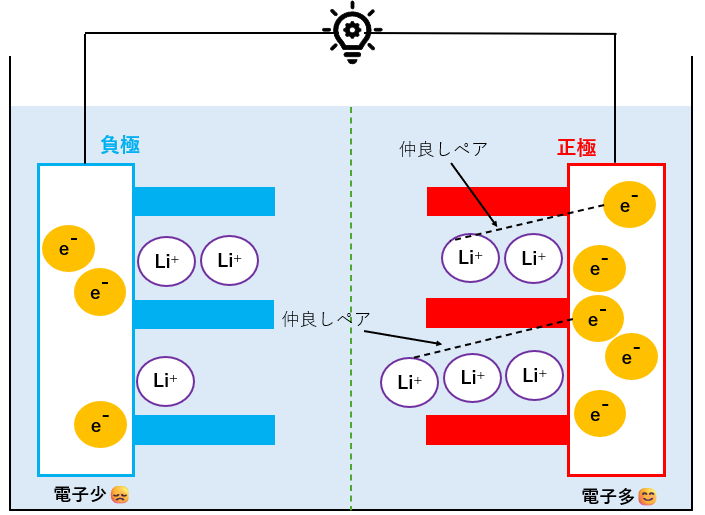
Li+と電子(2組の仲良しペア)の移動が終わった様子です。
正極側の電子が多くて、負極側の電子が少なくなっていることが分かります。
発電には、電子が負極→正極に流れることが必要なので、負極の電子が減り続けて限界を迎えると、発電ができなくなり、再び充電が必要になります。
注意事項
今回は説明を簡単にするために1~2個のリチウムイオンと電子のみが動いたと仮定しましたが、実際はもっと大量のイオンと電子が動いています。
また、それぞれ一つのLi+と電子がペアを組んでいるわけではありません。全体として、Li+が動くと電子がそれに伴って動きます。
4. なんでリチウムなの?
リチウムはイオンと電子に分かれやすい
LiはイオンLi+と電子に分かれやすい特質を持っています。
楽しい!釣りの自然科学(第7回 釣りでも活躍するリチウム電池とは?)|ANA
先ほどのリチウムイオン電池で、イオンと電子が主役になることを見ましたよね?
だから、イオンと電子に分かれやすいリチウムはめっちゃ電池と相性が良いんです!
リチウムは色んな場所に、たくさんある
また、「リチウム(Lithium)」という名前の由来は、ギリシャ語の「lithos(λίθος)」= “石”から来ています。石の中から見つかったからこの名前が付けられたみたいなんです。
さらに、リチウムは石の中だけでなく、海水中などいろいろなものの中に含まれており、世界中にたくさん存在してるんです!
だから、たくさんの量が必要になる電池を作る原料として、リチウムはベストマッチなんです!
リチウムは軽いから、電池の軽量化・小型化に有利
リチウムは原子番号が3番なので、めっちゃ軽い!
だから電池を軽量化・小型化するのに便利なんです!
この事情があるので、スマホやモバイルバッテリーなど手軽に扱える充電可能な電化製品にはリチウムイオン電池が使われているんです!
5. おわりに:電気を持ち運ぶってすごい!
モバイルバッテリーって、目には見えない「電子」と「イオン」の動きを、化学のチカラでコントロールするすごい装置なんです。
「電気をためる」なんて、一見不思議なことだけど、
- リチウムイオンの引っ越し
- それに伴う電子の流れ=電流の発生
という単純な描像によって理解できるんです!
6.参考文献
1.第1回 リチウムイオン電池とは?専門家が語る、その仕組みと特徴 [muRata]
2.リチウムイオン電池の仕組みとは?長持ちさせる方法も解説 [株式会社 SKT]
3.『元素のすべてがわかる図鑑』 (監修:若林 文高)